宁波材料所在自抗凝透析器研究方面取得系列进展
我国慢性肾病患者高达1.2亿人,已发展成终末期肾病患者有200万,目前仅有30多万人接受透析治疗,治疗率仅为15%,远低于欧美国家的90%。中国血液透析市场主要由德国费森尤斯、日本尼普洛等占据,血液透析行业的市值约为1000亿-1400亿人民币,是中国最具潜力的蓝海市场之一。血液透析符合《“健康中国2030”规划纲要》等国家政策,具有制备技术壁垒高、多学科交叉等特点。血液透析器是人工肾系统的核心元件。尿毒症患者需要终生透析,随着我国进入老龄化社会,以及城乡居民大病保险试点政策的启动推广,我国对血液透析器的需求将出现井喷式增长。因此研发具有自主知识产权的高性能透析膜/器具有重要的民生和社会意义。
常用的血液透析聚合物膜,由于血液相容性较差,在与血液接触时,会引发血小板的粘附、聚集和释放反应,导致凝血机制异常造成凝血及血栓等临床反应。而目前临床上常用的抗凝手段主要是直接注射抗凝剂(如未分级肝素及低分子量肝素),起到抗凝血、抗血栓等多种功用。然而大量肝素的使用往往会加大患者的出血风险。并且肝素长期依赖也会导致血小板减少症(HIT)、皮肤反应、血浆脂解活性的抑制、嗜酸粒细胞增多、高钾血症、骨质疏松等副作用。因此如何发展自抗凝透析器,实现无肝素透析是目前血液透析的发展趋势。
中国科学院宁波材料技术与工程研究所先进功能膜团队于2014年开始进行透析膜方面的研究,并于近期取得了系列进展。
1)膜微孔结构调控:发展了一种生物相容性良好的聚乳酸血液透析膜,并系统探索了聚乳酸膜的相转化结构调控机理。可实现海绵状孔/指状孔等梯度结构有效调控(Journal of Membrane Science 2015, 478, 96-104),并且针对聚乳酸微孔膜结晶度低和耐热性差的问题,发展了界面交联诱导结晶的方法,提高了微孔膜的结晶度及耐热温度(Journal of Membrane Science 2016, 513, 166-176,ACS Biomaterials Science & Engineering 2016, 2 , 2207–2216)。
2)膜表面抗凝分子修饰:通过膜表面多巴胺固定肝素(Journal of Membrane Science 2014, 452, 390-399)、膜表面两性离子化(Journal of Membrane Science 2015, 475, 469-479)、表面PEG化(ACS Applied Materials & Interfaces 2015, 7, 17748-17755)、膜表面水蛭素修饰(Journal of Membrane Science 2017, 523, 505-514)改善聚乳酸微孔膜的亲水性及血液相容性,揭示了膜表面亲水抗蛋白吸附和类肝素抗凝分子抑制凝血瀑布效应的机理。
3)自抗凝透析器:中空纤维透析器内含超过1万根中空纤维膜,其内径通常小于200微米,在微米级的限域通道内实现亲水和抗凝分子的修饰具有非常大的挑战性。目前临床用的聚砜和聚醚砜类透析器通常采用在相转化过程中共混高分子量聚乙烯吡络烷酮(PVP)实现其亲水抗凝修饰,但是PVP与聚砜或聚醚砜存在相容性差异,通常易在膜表面析出形成“布丁”粒子,在透析过程中形成挂血点,并容易进入血液当中。针对该问题,研究团队发展了一种基于微孔膜的Top-down迁移及界面交联功能化策略(Journal of Membrane Science 2016, 520, 769-778,Journal of Membrane Science 2016, 513, 166-176),实现了抗凝分子在微孔膜表面的修饰,进一步地通过可控聚合技术合成了具有亲水基团(乙烯基吡咯烷酮)和抗凝基团(磺酸基团和羧酸基团)、具有序列排列结构的共聚物,通过微流控技术实现抗凝聚合物在透析器限域通道内的均匀分布,及界面交联固定,最终通过亲水基团的抗蛋白吸附以及磺酸羧酸基团的抗凝机理协同提高透析器的血液相容性,如图1-3所示,实现了整支透析器的自抗凝修饰,模拟透析实验表明自抗凝透析器具有良好的中小分子清除性能,具有潜在的临床应用前景。上述工作作为邀请论文发表在Journal of Membrane Science 2018, 563, 115-125。
上述研究得到国家自然科学基金(51473177),中科院青年创新促进会(2014258),宁波市生命健康重大项目(2017C110034)的资助支持。

图1 自抗凝透析器及膜表面抗血小板吸附
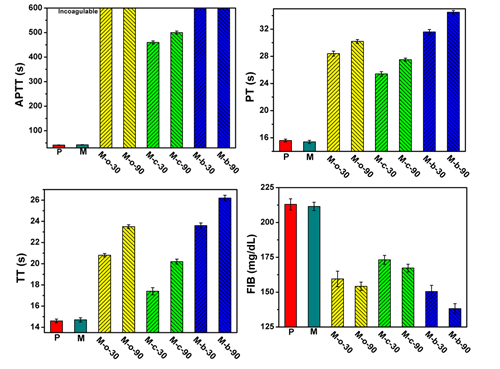
图2 自抗凝透析膜表面凝血四项指标:APTT(活化部分凝血活酶时间),PT(凝血酶原时间),TT(凝血酶时间)和FIB(纤维蛋白原),其中APTT超过600s,表现出高抗凝特性

图3 自抗凝透析膜内外表面形貌
(高分子事业部 刘富)
